Periyodik Tablonun Özellikleri
Periyodik tabloya elementler artan atom numaralarına göre yerleştirilir .Yan yana sıralanan elementler satırları oluştururken, benzer özellik gösteren elementler ise alt alta gelecek şekilde sıralanarak sütunları oluşturur.
Periyodik sistemde yatay olan satırlara periyot, dikey sütunlara ise grup adı verilir . Periyodik sistemde toplam 7 periyot, 8 tanesi A, 10 tanesi B grubu olmak üzere toplam 18 grup bulunur.
Biz bu yıl yalnızca ilk 20 element atomu ile uğraşacağımız için B grupları ile uğraşmayacağız.
Periyodik sistemde yer alan periyot ve gruplar aşağıdaki gibi gösterilebilir.
.png)
Periyodik tablomuz hakkında bilinmesi gerekenler:
- 1. Yatay sırada yani 1 periyotta yalnızca 2 atom (H , He) vardır.
- 2. ve 3. periyotta 8 ' er element bulunur.
- 4. ve 5 periyotta 18 ' er element bulunur
- 6. ve 7 periyotta 32 şer element vardır. Ayrıca 7. periyot daha tamamlanmamıştır.
Grupların özel adları ve benzer özellikleri :
1A Grubunun Özellikleri :
- Grubun özel adı : Alkali Metalllerdir
- Hidrojen hariç hepsi metaldir .
- 1 elektron vererek 1+ yüklü olmaya yatkındırlar.
2A Grubunun Özellikleri :
- Grubun özel adı : Toprak Alkali Metaller'dir.
- Gruptaki elementlerin hepsi metaldir.
- Bileşiklerinde 2 elektron vererek 2+ yüklü olmaya yatkındırlar.
7A grubunun Özellikleri :
- Grubun özeldı : halojenlerdir.
- Gruptaki elementlerin hepsi ametaldir.
- Bileşik oluşturuken genellikle 1 elektron alarak 1 - değerlik alırlar.
8A Grubunun Özellikleri
- Grubun özel adı : Asal Gazlar yada Soygazlardır.
- Gruptaki elementlerin hepsi kararlıyapıya sahiptir.
- Bileşik oluşturmazalar
- He hariç son yörüngelerinde 8 elektron bulundururlar.
Periyotdik Tabloda Adres Bulma : Periyodik tabloda adres bulunurken önce elementin elektron dağılımı yapılır. daha sonra elementin katman sayısı bize periyot numarasını , son katmanındaki elekron sayısı ( DEĞERLİK ELEKTRON SAYISI) elementin grup numarasını verir.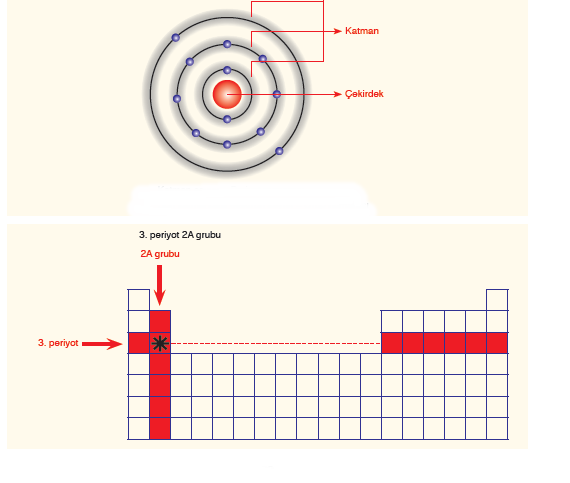
Yukarıdaki örnekte görüldüğü gibi elementimizin _ katman sayısı 3 o zaman 3 periyotta ve
_Değerlik elektron sayısı 2 o zaman 2A grubunda olarak elmentimizin tablodaki yerini söyleyebiliz.
|
Örnek : 13Al elementinin periyodik tablodaki yerini bulalım. ) ) ) 13Al 2e 8e 3e Son katmana bakıyoruz : 3 katmanı var : 3. Periyot 3 değerlik elektronu var : 3A grubu
|
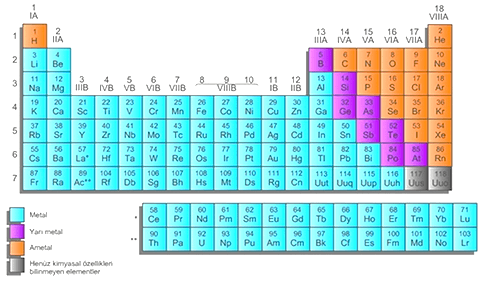
Periyodik Tablodaki Elementlerin Sınıflandırılması :
Tablodaki Elementler: Metaller , Ametaller ve Yarı Metaller olarak 3 gruba ayrılır.
Soygazlar ise Ametallerin özel bir grubu olarak söylenebilir.
METALLER:
- Parlaktır.
- Oda sıcaklığında, cıva hariç katı hâldedir.
- Isı ve elektriği iyi iletir.
- Kararlı hâle geçmek için genelde elektron
- vererek katyon oluşturur.
AMETALLER: Hey CeNaP Osman Flor Clorun Brnunu Isırdı
- Parlak değildir.
- Tel ve levha hâline getirilemez.
- Oda sıcaklığında katı, sıvı ve gaz hâlde bulunur.
- Isı ve elektriği iyi iletmez.
- Kararlı hâle geçmek için genelde elektronalarak anyon oluşturur.
Soygazlar : Hergele Necmi Arsızdır.
- Kararlı yapıda oldukları için elektron
- almaz ya da vermez, katyon ve anyon oluşturmaz.
Diğer özellikleri ametaller ile aynıdır..............
YARI METALLER : fiziksel özellikleri yönü ile metallere kimyasal özellikleri yönü ile ametallere benzerler