Maddenin Tanecikli Yapısı
7.3.1. MADDENİN TANECİKLİ YAPISI
7.3.1.1. Atomun yapısını ve yapısındaki temel parçacıkları bilir.
7.3.1.2. Geçmişten günümüze atom kavramı ile ilgili düşüncelerin nasıl değiştiğini sorgular.
7.3.1.3. İyonların nasıl oluştuğunu kavrar, anyon ve katyonlara örnekler verir.
7.3.1.4. Aynı ya da farklı atomların bir araya gelerek molekül oluşturacağını kavrar.
7.3.1.5. Çeşitli molekül modelleri oluşturur ve sunar.
Maddenin yapı taşına Atom denir. Atom elementlerin özelliğini gösteren en küçük parçasıdır.
Atomdan daha küçük parçacıklar da vardır. Bunlar elektronlar , nötronlar ve protonlardır.
Proton
- Çekirdekte bulunur.
- + yüklü parçacıktır.
- Sembolü ( p+ )
- Nerede ise hiç hareket etmez
Nötron
- Çekirdekte bulunur.
- Yüksüz parçacıktır.
- Kütlesi protonun kütlesi ile aynıdır.
- Sembolü ( n0 )
- Çekirdekte nerede ise hiç hareket etmez.
Elektron
- Çekirdek etrafında çok hızlı hareket eder.
- Katmanlarda bulunur.
- ( - ) yüklü parçacıktır.
- Kütlesi protonun kütlesinin yanın da çok küçüktür.
- Sembolü ( e- ) dir .
Atom da proton (p+ ) ve elektron (e- ) eşit sayıda bulunur. Nötron sayısı ise farklı olabilir.
Atomun merkezinde bulunan ve proton ve nötronların bulunduğu bölgeye çekirdek, elektronların döndüğü yörüngelere ise katman adı verilir.

Atomun hacmini yörüngelerde hızlı hızlı dönen elektronlar oluşturur. Atomun hacmi bir futbol sahası kadar olmuş olsaydı. Atom çekirdeği ancak bir futbol topu kadar olacaktı.
Atomun kütlesi ise çekirdekte toplanmıştır. Kütleyi proton ve nötronların toplamı oluşturur.
ATOM KÜTLESİ = Proton sayısı + Nötron sayısı
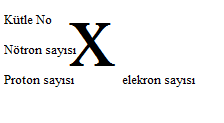
Yukarıda bir atom sembolü ve bu atam sembolü üzerin de sahip olduğu parçacıkların yazılışı gösterilmiştir.
Atomun yapısı ile ilgili özellikler.
- Atomun kimliğini p+ sayısı belirler
- Atomun hacmini katmanlarda dönen e- lar oluşturur.
- Atomun kütlesini p+ ve n0 parçacıkları belirler.
- Atomlarda p+ sayısı e- sayısına eşittir.
- Aynı cins atomların proton sayısı kesinlikle aynıdır.
- Atomun kütlesi çekirdekte toplanmıştır.
Atom Kavramının Tarihsel Gelişimi: Bilim insanları atoma nediyor ?,

1. Democritus (Demokritus) : O zamanlar da daha bilim ve bilim adamı kavramı yoktu . Türklerin aksakal , avrupalıların filozof dediği herşeyi bilen bilge insanlar vardı. Democritus (Demokritus) da bir yunan bilginidir . Democritus maddelerin parçalanamayan tanciklerden oluştuğunu söyledi ve bu taneciklere bölünemez anlamına gelen ATOMOS dedi. Bunu bilimsel yöntemlerle değil , sadece bir düşünce olarak ortaya atmıştır. Demokritus'a göre bütün maddeler aynı cins atomlardan oluşmuştur.

2. John Dalton
Atom konusunda ilk bilimsel çalışmayı yapan bilim insanıdır . J. Dalton`a göre maddenin en küçük yapı birimi atomdur. Atomlar, içleri dolu berk (sıkı) kürelerdir . Her maddenin kendine özgü atomlardan oluştuğunu yani altının atomlarının altın bakırın atomlarının bakır olduğunu söylemiştir.

3. J.J. Thomson
Atomun yapısını üzümlü keke benzeterek açıkladı. Kekin hamurunu (+ ) yüklere dağınık halde bulunan üzümleri de (-) yüklere benzetti . Negatif yüklerin hareket etmediğini de söylemişti. Atomun parçalanabileceği fikrini ilk olarak ortaya atmıştır .

4. Rutherford
Pozitif yüklere proton, Protonun bulunduğu yere çekirdek adını verdi. Çekirdek etrafında elektronların hareket halinde olduğunu ve atomun hacmini elektronların dönerek oluşturduğunu yaptığı etkinlik ile gösterdi . Etkinliğinde çok ince bir altın plakayı elektron bombardımanına tuttu ve elektronların pek çoğunun altın plakanın diğer tarafına geçtiğini pek azının geçemediğini fark etti. Bu durumda altının kütlesinin atomun küçük bir bölümünde toplandığını ve büyük bölümünün boşluklardan oluştuğunu fark etti . Yaptığı model güneş sistemine benzetmiştir.

5. Niels Bohr
Bohr atom modeline göre protonlar ve nötronlar çekirdekte , elektronlar çekirdeğin belirli uzakllığındaki katmanlarda dolanmaktadır.
6. Modern atom teorisi
Elektronlar çok hızlı hareket ettikleri için, elektronların yerini tam olarak belirleyemeyiz. Elektronların bulunma ihtimalinin fazla olduğu yerler vardır bu yerlere : “Elektron Bulutu” denir. Elektronların sabit yörüngeleri olmadığı için Bohr atom modelin de olduğu gibi yörüngelerden (katmanlardan) bahsetmek zordur. Katman yerine elektron bulutu kullanılmaktadır.
BİLGİ : Tarihsel süreç içerisinde atom fikri pek çok kez değişikliğe uğramıştır. Fakat tamamlanmış , değişmez bir konu da değildir. Değişmeye açık bir konudur.
İyon Kavramı :
Atomlar da bulunan: protonlar ve elektronlar elektriksel yüklerle ( +,- ) yüklü parçacıklardır. Çekirdekte bulununan nötronlar ve protonların kütleleri fazla hareketsizdirler. Bu nedenle atomlar arasında bu parçacıklar alınıp verilmez . Elektronlar ise küçük ve hareketli olduklarından atomlar arasında alınıp verilebilir.
atomda normal durumda e- ve p+ ların sayısı bir birine eşittir. yani atom nötr haldedir. Elektron alış - verişi yapılınca (+) , (-) eşitliği bozulur ve atom (+) yada ( - ) yüklü iyon haline geçer.

Tabloda da görüldüğü gibi lityum atomu bir (-) vermiş ve yükler karşılaştırılınca (+) yüklerin 1 tane fazla olduğu görülüyor o zaman 1+ yüklü denir ve Li 1+ şeklinde gösterilir. Yükler karşılaştırılır ve hangi çeşit yükten kaçtane fazla varsa sağ üst köşeye yazılır.
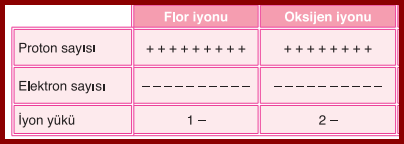
F1- , O2- şeklinde gösterilir.
+ yüklü iyonlara Katyon---> Ka(t)yon
- yüklü iyonlara Anyon denir.
-Atomların bir araya gelerek oluşturdukları kümelere molekül denir.
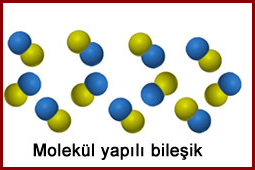
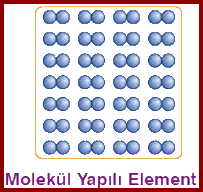
molekülü oluşturan atomlar aynı cins atomlardan oluşuyorsa element molekülü , farklı cins atamlardan oluşuyorsa bileşik molekülü olarak söylenir.